Exploring Atomic Structure : এই প্রতিবেদনে নবম শ্রেণীর ভৌত বিজ্ঞানের (Physical Science) পরমাণুর গঠন (Atomic Structure) অধ্যায় থেকে বিভিন্ন রকম গুরুত্বপূর্ণ প্রশ্ন এবং উত্তর আলোচনা করা হয়েছে।
ছাত্র-ছাত্রীদের যাতে বুঝতে কোন রকম অসুবিধা না হয়। তারা যাতে খুব সহজে পরমাণুর গঠন সম্পর্কে একটা ভালো ধারণা লাভ করতে পারে এবং সেখান থেকে পরীক্ষার জন্য সুন্দর একটা প্রস্তুতি নিতে পারে, তার জন্যই আজকের এই প্রশ্নোত্তর পর্ব:
1.ক্যাথোড রে বলতে কী বোঝো?
উইলিয়াম ক্রুকস দুই প্রান্তে দুটি ধাতব তড়িৎদ্বার যুক্ত তড়িৎ মোক্ষণ নলে 0.01 mm Hg চাপে রাখা বায়ুর ভেতর দিয়ে উচ্চ বিভব যুক্ত DC তড়িৎ প্রবাহ চালনা করেন ।তখন তিনি লক্ষ্য করেন যে ক্যাথোড থেকে অ্যানোড এর দিকে একপ্রকার অদৃশ্য রশ্মি সরলরেখায় নির্গত হচ্ছে এবং ক্যাথোড এর বিপরীত দিকের কাচ দেওয়ালে সবুজ রঙের প্রতি প্রভা সৃষ্টি করছে। এই রশ্মি গুলিকে ক্যাথোড রশ্মি বলা হয়।
2.ক্যাথোড রশ্মির ধর্ম গুলি লেখ।
ক্যাথোড রশ্মির ধর্মগুলি হল:
1.ক্যাথোড রশ্মি নেগেটিভ তড়িৎ বিশিষ্ট ইলেকট্রন কনার স্রোত।
2.এই রশ্মি ক্যাথোড তল থেকে লম্ব ভাবে বেরিয়ে আসে।
3.এই রশ্মি খুবই ক্ষুদ্র ভর সম্পন্ন ক্ষুদ্র ক্ষুদ্র কণা দ্বারা তৈরি।
4.তড়িৎ ক্ষেত্র বা চৌম্বক ক্ষেত্র দ্বারা এই রশ্মির গতির অভিমুখ পরিবর্তন হয়।
3. জে . জে . থমসনের পরমাণু মডেলটির নাম কি?
জে . জে . থমসন বলেছিলেন যে, পুডিং এর ভেতর যেমন কিসমিস গাঁথা থাকে অথবা তরমুজের ভেতরে যেভাবে বীজগুলি সাজানো থাকে ঠিক সেভাবেই ইলেকট্রন গুলি পরমাণুতে বিন্যস্ত থাকে। তাই একে পাম পুডিং মডেল বা ওয়াটারমেলন মডেলও বলা হয়।
4. অ্যানোড রশ্মি বলতে কি বোঝো?
বিজ্ঞানী গোল্ডস্টাইন তড়িৎ মোক্ষণ নলে ক্যাথোড রশ্মি সংক্রান্ত পরীক্ষার সময় ছিদ্রযুক্ত ক্যাথোড ব্যবহার করে দেখেন যে অ্যানোডের দিক থেকে ক্যাথোডের দিকে এক ধরনের অদৃশ্য রশ্মি দ্রুতগতিতে ছুটে যাচ্ছে। তিনি এই রশ্মির নাম দিয়েছিলেন অ্যানোড রশ্মি।
5. অ্যানোড রশ্মির দুটি বৈশিষ্ট্য লেখো।
অ্যানোড রশ্মির বৈশিষ্ট্য হল:
- এই রশ্মি পজিটিভ আধানযুক্ত কণার সমষ্টি। যে কারণে জে . জে . থমসন এই রশিকে পজিটিভ রশ্মি নাম দেন।
- এই রশ্মির প্রতিটি কণার ভর সাধারণ হাইড্রোজেন পরমাণুর ভরের সমান।
- এই কণাগুলিকে বিজ্ঞানীরা পড়ে নাম দেন প্রোটন।
6. তেজস্ক্রিয়তা কে আবিষ্কার করেন?
ফরাসি বিজ্ঞানী হেনরি বেকারেল পটাশিয়াম ইউরেনিল সালফেট নামক ইউরেনিয়াম ধাতুর লবণ নিয়ে X রশ্মি সংক্রান্ত পরীক্ষার সময় লক্ষ্য করেন যে পদার্থটি থেকে ভেদন ক্ষমতা সম্পন্ন একপ্রকার অদৃশ্য রশ্মি স্বতঃস্ফূর্তভাবে নির্গত হচ্ছে। তিনি এই রশ্মির নাম দেন বেকারেল রশ্মি পরে এই রশ্মির নাম দেয়া হয় তেজস্ক্রিয় রশ্মি। যে পদার্থ থেকে এই ধরনের রশ্মি বের হয় তাদের বলা হয় তেজস্ক্রিয় পদার্থ এবং এই ঘটনাকে বলা হয় তেজস্ক্রিয়তা।
7. রাদারফোর্ড α-কণা বিচ্ছুরণ পরীক্ষার মাধ্যমে কিভাবে পরমাণুর গঠন সম্পর্কে ধারণা পেয়েছিলেন?
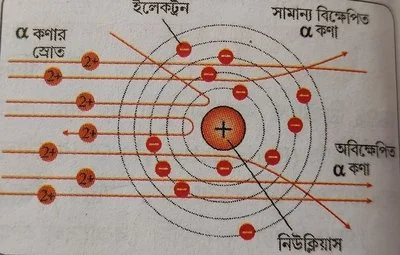
বিজ্ঞানী রাদারফোর্ড একটি বায়ু শূন্য আবদ্ধ নলে খুব পাতলা সোনার পাতের (0.0004 mm পুরু) ওপর তীব্র গতি সম্পন্ন α-রশ্মি চালনা করেন। তিনি লক্ষ্য করেন যে অধিকাংশ α-কণা ধাতব পাত ভেদ করে সোজা বেরিয়ে যাচ্ছে। অতি অল্প সংখ্যক α-কণা (প্রায় কুড়ি হাজারের মধ্যে একটি) বিক্ষেপিত হয়ে যে পথে যাচ্ছে সেই পথেই ফিরে আসছে। আর কিছু সংখ্যক α-কণা অল্প কোণে বিক্ষেপিত হয়ে ধাতব পাত ভেদ করে বেরিয়ে যাচ্ছে। যেহেতু ধাতব পাত ধাতব পরমাণুর সমবায় গঠিত তাই যেহেতু অধিকাংশ α-কণা পাত ভেদ করে সোজা বেরিয়ে যাচ্ছে সুতরাং তিনি এই সিদ্ধান্তে উপনীত হলেন যে পরমাণুর বেশিরভাগ স্থানই ফাঁকা।
আবার α-কণা ধনাত্মক তড়িৎ যুক্ত। একমাত্র ধনাত্মক চার্জই ধনাত্মক চার্জ কে বিকর্ষণ করতে পারে, তাই অল্প কিছু α-কণার বিক্ষেপণের ঘটনা থেকে তিনি অনুমান করলেন যে পরমাণুর সমগ্র আয়তনে তুলনায় অতি ক্ষুদ্র এক স্থানে পরমাণুর সমগ্র ধনাত্মক চার্জ এবং সমগ্র ভর সঞ্চিত থাকে। একেই কেন্দ্রক বা নিউক্লিয়াস বলে।
এরপর কিছু α-কণা যে পথে যায় সেই পথেই বিক্ষিপ্ত হয়ে ফিরে আসার ঘটনার সাহায্যে তিনি এই সিদ্ধান্তে উপনীত হলেন যে পরমাণুর কেন্দ্রে নিউক্লিয়াস একটি নিরেট অংশ। যে আলফা কণাগুলি ওই অংশে বাধা প্রাপ্ত হচ্ছে তারাই গতিপথ পরিবর্তন করে বিপরীত পথে ফিরে আসছে।
8. রাদারফোর্ডের পরমাণু মডেল ব্যাখ্যা কর।
“আলফা কণার বিচ্ছুরণ” পরীক্ষার পর্যবেক্ষণ ও সিদ্ধান্তের ভিত্তিতে বিজ্ঞানী রাদারফোর্ড পরমাণুর একটি মডেল প্রস্তাব করেন।
রাদারফোর্ডের পরমাণু মডেল অনুযায়ী পরমাণুর দুটি অংশ যার একটি হল পরমাণুর কেন্দ্রক বা নিউক্লিয়াস এবং অপরটি হল নিউক্লিয়াসের বাইরে ইলেকট্রন মহল।
কেন্দ্রক বা নিউক্লিয়াস:
যেকোনো পরমাণুর কেন্দ্রে অতি অল্প স্থানে এটি কেন্দ্রীভূত থাকে। এখানে ধনাত্মক আধানযুক্ত প্রোটন কণা অবস্থান করে তাই পরমাণুর কেন্দ্র বা নিউক্লিয়াস ধনাত্মক হয়। পরমাণুর ব্যাস এর তুলনায় নিউক্লিয়াসের ব্যাস অনেক কম হয়। তাই বলা যায় পরমাণু নিরেট নয় এর বেশিরভাগ অংশই ফাঁকা।
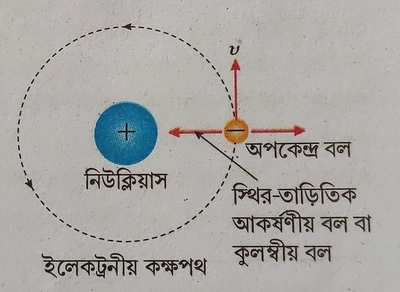
নিউক্লিয়াসের বাইরে ইলেকট্রন মহল:
নিউক্লিয়াসের বাইরে একাধিক বিভিন্ন কক্ষপথে ঋণাত্মক তড়িৎগ্রস্ত ইলেকট্রন কণাগুলি ঘুরতে থাকে। পরমাণুর নিউক্লিয়াসের ঠিক যতগুলি প্রোটন কণা থাকে নিউক্লিয়াসের বাইরে ঠিক ততগুলি ইলেকট্রন থাকে। একটি প্রোটনের আধান এবং একটি ইলেকট্রনের আধান সমান ও বিপরীত হবার কারণে একটি পরমাণুতে প্রোটন গুলির মোট পজিটিভ তড়িৎ আধান এবং ইলেকট্রন গুলির মোট নেগেটিভ তড়িৎ আধান সমান হয়। তাই পরমাণু নিস্তড়িত হয়। রাদারফোর্ডের পরমাণু মডেল অনুযায়ী নিউক্লিয়াসকে কেন্দ্র করে বৃত্তাকার কক্ষপথে ইলেকট্রনগুলি সম দ্রুতিতে নিউক্লিয়াসের চারপাশে বিভিন্ন কক্ষপথে আবর্তন করে। এখানে নিউক্লিয়াস ও ইলেকট্রনের মধ্যে ক্রিয়াশীল স্থির তড়িৎ আকর্ষণ বল ইলেকট্রন কে বৃত্তাকার পথে আবর্তনের জন্য প্রয়োজনীয় অভিকেন্দ্র বল সরবরাহ করে।
9. রাদারফোর্ডের পরমাণু মডেলের দুটি ত্রুটি উল্লেখ কর।
রাদারফোর্ডের পরমাণু মডেলের দুটি ত্রুটি হল:
- ম্যাক্সওয়েলের তড়িৎচুম্বকীয় তরঙ্গের তত্ত্ব অনুযায়ী ধনাত্মক আধানযুক্ত নিউক্লিয়াসকে কেন্দ্র করে ঋণাত্মক আধানযুক্ত ইলেকট্রন কনা বৃত্তাকার কক্ষপথে সমগতিতে ঘুরতে থাকলে তা নিরবিচ্ছিন্নভাবে শক্তি বিকিরণ করতে থাকবে অর্থাৎ ইলেকট্রনের শক্তি ক্রমশ কমতে থাকবে। এর ফলে ইলেকট্রন গুলি আস্তে আস্তে নিউক্লিয়াসের দিকে এগিয়ে যাবে এবং নিউক্লিয়াসের উপর আছড়ে পড়বে। কিন্তু বাস্তবে এমনটা হয় না প্রত্যেক পরমাণুরই নির্দিষ্ট স্থায়ী গঠন আছে।
- ঘূর্ণায়মান ইলেকট্রন নিরবচ্ছিন্নভাবে শক্তি বিকিরণ করলে পরমাণুর নিরবচ্ছিন্ন বর্ণালী পাওয়ার কথা, কিন্তু বাস্তবে রেখা বর্ণালী বা বিচ্ছিন্ন বর্ণালী পাওয়া যায়।
10. নিউট্রন কে আবিষ্কার করেন?
বিজ্ঞানী স্যাডউইক(1932) নিউট্রন আবিষ্কার করেন।
11. নিউক্লিয়ন কাকে বলে?
পরমাণুর নিউক্লিয়াসে ধনাত্মক আধানযুক্ত প্রোটন এবং নিস্তরিত নিউট্রন কণাগুলিকে একত্রে নিউক্লিয়ন বলা হয়।
13. বোর-রাদারফোর্ড পরমাণু মডেল সংক্ষেপে বর্ণনা কর।
বিজ্ঞানী নীলস বোর রাদারফোর্ডের পরমাণু মডেলের ত্রুটি সংশোধন করে পরমাণুর যে গঠন চিত্র রচনা করেন তাই বোর-রাদারফোর্ড পরমাণু মডেল নামে পরিচিত।
তিনি বলেন:-
- 1.পরমাণুর ইলেকট্রনগুলি নিউক্লিয়াস কে কেন্দ্র করে ইচ্ছামত যে কোন বৃত্তাকার কক্ষপথে আবর্তন করতে পারেনা, কেবলমাত্র কতগুলি নির্দিষ্ট ব্যাসার্ধের বৃত্তাকার কক্ষপথেই আবর্তন করে।
- এইসব নির্দিষ্ট বৃত্তাকার কক্ষপথ গুলির যে কোনোটিতে আবর্তন করার সময় ইলেকট্রন কোন শক্তি বর্জনও করে না গ্রহনও করেনা তাই এগুলিকে স্থায়ী বা সুস্থির কক্ষপথ বলা হয়। এই সুস্থির পথ গুলির প্রত্যেকটিকে এক একটি মুখ্য শক্তি স্তর বলা হয়। কোন একটি মুখ্য শক্তি স্তরে সর্বাধিক 2n² সংখ্যক ইলেকট্রন থাকতে পারে যেখানে n হলো মুখ্য শক্তি স্তর বা কক্ষের ক্রমিক সংখ্যা।
- নিউক্লিয়াস থেকে যত দূরে যাওয়া যাবে কক্ষপথের শক্তি ততই বৃদ্ধি পাবে। কোন ইলেকট্রন উচ্চশক্তির কক্ষ থেকে নিম্ন শক্তির পক্ষে ঝাঁপ দিলে ইলেকট্রন টি নির্দিষ্ট পরিমাণ শক্তি বিকিরণ করবে অন্যদিকে কোন ইলেকট্রন নির্দিষ্ট পরিমাণ শক্তি শোষণ করে নিম্নতর পক্ষ থেকে উচ্চতর কক্ষে উন্নীত হতে পারবে।
14.বোর-রাদারফোর্ড পরমাণু মডেলের দুটি ত্রুটি উল্লেখ কর।
বোর রাদারফোর্ড পরমাণু মডেলের দুটি ত্রুটি হল:
- এই মডেলের সাহায্যে দুই বা ততোধিক ইলেকট্রন বিশিষ্ট পরমাণু বা আয়নের বর্ণালী ব্যাখ্যা করা যায় না।
- এই পরমাণু মডেল দ্বিমাত্রিক। তাই পরমাণুর প্রকৃত ত্রিমাত্রিক গঠন সম্পর্কিত কোন ধারনা এই মডেল থেকে পাওয়া যায় না।
15. পারমাণবিক সংখ্যা বা পরমাণু ক্রমাংক কাকে বলে?
কোন মৌলের পরমাণুর নিউক্লিয়াসে যতগুলি প্রোটন থাকে সেই সংখ্যাকে ওই মৌলের পারমাণবিক সংখ্যা বলে।
16. পারমাণবিক সংখ্যাকে মৌলের মূলগত ধর্ম বলা হয় কেন?
কোন মৌলের নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যাই হলো তার পারমাণবিক সংখ্যা, যা মৌলের প্রকৃতি নির্ধারণ করে। পারমাণবিক সংখ্যা পরিবর্তিত হলে মৌলের ভৌত ও রাসায়নিক ধর্মাবলীও বদলে যায়। অর্থাৎ এক মৌল অন্য মৌলে রূপান্তর হয়ে যায়। সুতরাং দুটি ভিন্ন মৌলের পারমাণবিক সংখ্যা কখনোই এক হতে পারে না। এই কারণে পরমাণু ক্রমাঙ্ক বা পারমাণবিক সংখ্যাকে মৌলের মূলগত বা স্বকীয় ধর্ম বলা হয়।
17. পারমাণবিক সংখ্যা বা পরমাণু ক্রমাঙ্ক সব সময় পূর্ণ সংখ্যার হয় কেন?
কোন পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটনের সংখ্যা কখনো ভগ্নাংশ হতে পারে না। এটি সর্বদা পূর্ণ সংখ্যায় হয়। আবার নিউক্লিয়াসে উপস্থিত প্রোটন সংখ্যাকেই মৌলের পারমাণবিক সংখ্যা বলা হয়। সুতরাং পারমাণবিক সংখ্যা সর্বদা পূর্ণ সংখ্যা হবেই।
18. কোন মৌলের পরমাণুর ভর সংখ্যা বলতে কী বোঝো।
কোন মৌলের পরমাণুর নিউক্লিয়াসে উপস্থিত প্রোটন ও নিউট্রনের মোট সংখ্যাকেই ওই মৌলের ভর সংখ্যা বলা হয়। যেমন একটি অ্যালুমিনিয়াম(Al) পরমাণুর নিউক্লিয়াসে 13 টি প্রোটন ও 14 টি নিউট্রন রয়েছে সুতরাং এর ভর সংখ্যা=13+14=27
19. নিউক্লাইড(Nuclide) কি ?
নির্দিষ্ট পারমানবিক সংখ্যা ও নির্দিষ্ট ভর সংখ্যা বিশিষ্ট এক একটি পরমাণুকে নিউক্লাইড বলে। যেমন 12Mg²4 এটি একটি ম্যাগনেসিয়াম মৌলের নিউক্লাইড।
20. আইসোটোপ কাকে বলে? উদাহরণ দাও। আইসোটোপের ব্যবহার লেখো।
আইসোটোপ বা সংস্থানিক:
একই মৌলের বিভিন্ন পরমাণু যাদের পারমাণবিক সংখ্যা একই কিন্তু ভরসংখ্যা আলাদা আলাদা। তাদেরকে ওই মৌলের আইসোটোপ বলে।
যেমন সাধারণ হাইড্রোজেন বা প্রোটিয়াম (1H¹), ডাইটেরিয়াম(1H²), এবং ট্রায়টিয়াম(1H³) এদের প্রত্যেকের 1 টি করে প্রোটন আছে। সাধারণ হাইড্রোজেনের কোন নিউট্রন নেই । ডইটেরিয়ামের 1 টি নিউট্রন আছে এবং ট্রায়টিআমের 2 নিউট্রন আছে। তাই এদের ভর সংখ্যা যথাক্রমে 1 , 2 ও 3 । যেহেতু এদের প্রোটন সংখ্যা একই কিন্তু ভর সংখ্যা ভিন্ন ভিন্ন তাই এরা পরস্পরের আইসোটোপ।
আইসোটোপের ব্যবহার:
জীবাশ্ম, প্রাচীন গাছ, ঐতিহাসিক বস্তু ,পৃথিবী ইত্যাদির বয়স নির্ধারণ করতে কার্বনের তেজস্ক্রিয় আইসোটোপ C14 ব্যবহার করা হয়।
ক্যান্সার টিউমার প্রভৃতি রোগের চিকিৎসায় তেজস্ক্রিয় আইসোটোপ P32 ,Co60 ইত্যাদি ব্যবহার করা হয়।
21.আইসোবার কাকে বলে? উদাহরণ দাও।
ভিন্ন পারমাণবিক সংখ্যা কিন্তু একই ভর সংখ্যা বিশিষ্ট ভিন্ন ভিন্ন মৌলের পরমাণু গুলিকে আইসোবার বলে।
যেমন Ar এবং Ca – এই দুটি পৃথক মৌলের পারমাণবিক সংখ্যা যথাক্রমে 18 এবং 20 কিন্তু ভর সংখ্যা দুটি মৌলের ক্ষেত্রেই 40 সুতরাং এরা পরস্পরের আইসোবার।
22.আইসোটোন কাকে বলে? উদাহরণ দাও।
একই নিউট্রন সংখ্যা বিশিষ্ট বিভিন্ন মৌলের পরমাণু গুলিকে পরস্পরের আইসোটোন বলে।
যেমন 1H² এবং 2He³ এই দুটি nuclide এর মধ্যেই নিউট্রন সংখ্যা সমান আছে। সুতরাং এরা পরস্পরের আইসোটোন।
23.নিউক্লিয় বল বলতে কী বোঝো?
বিজ্ঞানী হাইসেনবার্গের মতে নিউক্লিয়াসের মধ্যস্থ প্রোটন(p) এবং নিউট্রনের(n) মধ্যে অবিরাম গতিতে আধান বিনিময়ের মাধ্যমে পারস্পরিক রূপান্তর ঘটতে থাকে (প্রোটন নিউট্রনে এবং নিউট্রন প্রোটনে রূপান্তরিত হতে থাকে) এর ফলে নিউক্লিয়ন গুলির মধ্যে শক্তিশালী আকর্ষণ বলের সৃষ্টি হয়। যাকে বলা হয় নিউক্লিয় বল।
তবে বর্তমানে বিজ্ঞানীদের মতে মেসন নামক এক ধরনের কণার অবিরত আদান-প্রদানের ফলে নিউক্লিয় বল সৃষ্টি হয় এবং নিউক্লিয়াস স্থিতিশীল হয়।
24.ইলেকট্রন কে আবিষ্কার করেন?
জে. জে. থমসন ইলেকট্রন আবিষ্কার করেন।
25.প্রোটন কে আবিষ্কার করেন?
বিজ্ঞানী গোল্ডস্টাইন এবং রাদারফোর্ড প্রোটন আবিষ্কার করেন।
